Дата публикации: 10.10.2025
У непосвящённого человека словосочетание «искусственные лёгкие» ассоциируется с больничной палатой, пациентом с кислородной маской на лице и аппаратом ИВЛ, который дышит за больного. А может ли человек выйти за больничные стены и продолжать жить активной жизнью, если его родные органы дышать отказываются? Да, если ему трансплантируют донорский орган. Но, несмотря на то что первые экспериментальные операции по пересадке лёгкого в нашей стране были выполнены ещё в послевоенном 1947 году, в стандартную клиническую практику они до сих пор не вошли. А людей, страдающих терминальными стадиями лёгочных заболеваний, к сожалению, меньше не становится.
Альтернативой донорским органам могут стать искусственные. И их уже создают, применяя технологии 3D-печати.
С 1993 года учёные из новосибирской компании «Кардиоимпульс» занимается разработкой и производством наукоёмкой промышленной техники. Около десяти лет назад в деятельности компании оформился ключевой приоритет – новейшие технологии в медицине. Специализация – кардиология, трансплантология, пульмонология. В числе реализованных проектов – аппарат интрапульмональной перкуссионной вентиляции лёгких. Он используется в респираторной терапии для стимуляции вовлечения лёгких в газообмен, вывода мокроты и улучшения микроциркуляции бронхиального кровотока (патенты: RU143568 Аппарат для интрапульмональной перкуссионной вентиляции лёгких; RU143259 Контур пациента для подачи газа). Вторая востребованная разработка — инсуффлятор-аспиратор, или медицинский откашливатель. Этот аппарат «заставляет» организм пациента осуществлять кашлевые толчки, удаляющие бронхиальный секрет. Третья, не менее актуальная инновация – инфузионный шприцевой насос для поддержки необходимого уровня жидкости в организме и точной дозировки лекарств.
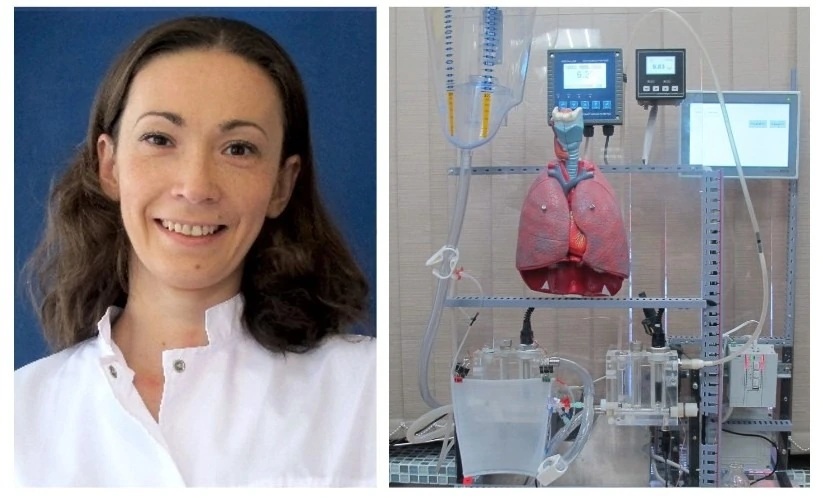
А три года назад в научном коллективе родилась идея создания искусственных лёгких на базе микрофлюидных технологий. Она стала основой проекта «Разработка опытного образца микрофлюидного капиллярного оксигенатора крови матричной структуры и проведение его экспериментальных исследований». Сокращённое наименование: «Устройство для насыщения крови кислородом» (искусственные лёгкие). Этот высокотехнологичный механизм предназначен для людей, страдающих хронической лёгочной недостаточностью.

— На финальной стадии, когда поддерживающая терапия не даёт эффекта и существующие методы лечения по объективным причинам не могут быть применены, таким людям показана пересадка лёгких. Микрофлюидный оксигенатор — мост к трансплантации лёгких. В августе 2022г. первый опытный образец искусственных лёгких был представлен нами на XVI Сибирской Венчурной ярмарке, которая проходила в рамках Международного технологического форума «Технопром-2022». Наш проект был признан победителем конкурса среди субъектов инновационной деятельности, проходившего под эгидой Министерства науки и инновационной политики Новосибирской области, и мы получили субсидию на его реализацию, — рассказывает Катерина Олеговна Головина, заместитель руководителя проекта.
На средства субсидии учёные разработали технологию производства искусственных лёгких в лабораторных условиях. Создали серию опытных образцов микрофлюидного оксигенатора. Выполнили комплекс медико-биологических исследований invitro (вне живого организма, «на стекле») на венозной крови и invivo (исследования в живых условиях) на лабораторном животном.
— В испытаниях in vitro опытный образец выполнял оксигенацию венозной крови с базового значения оксигемоглобина 51,8 ± 1% до 97 ± 0,4%, при этом показатель сатурации крови достигал 99%, что полностью удовлетворило ожидаемые результаты исследований. В экспериментах in vivo микрофлюидный оксигенатор был подключён к животному. Аппарат ИВЛ в эксперименте не применяли. За счёт работы микрофлюидного оксигенатора показатель оксигемоглобина достигал 92±0,9% (при базовом значении 41%). По результатам проведённых исследований была доказана высокая эффективность микрофлюидного оксигенатора, — продолжает Катерина Олеговна.
— Что собой представляет этот прибор, как он работает?
— Это микрокапиллярная эластичная ёмкость, состоящая из мембранных элементов. Скорость потока в каждом регулируется от 5 мл/мин до 60 мл/мин. Такая система регулирования кровотока позволяет масштабировать устройства для поддержания минутного объёма кровотока (МОК) от 5 до 5 тыс. мл/мин. Сегодня разработкой микрофлюидных оксигенаторов занимаются ведущие научные центры Канады, США, Франции, и др. Отличительная особенность разработанного нами образца в том, что у нас мембранные элементы состоят из трёх слоёв. Два слоя предназначены для кислорода и один слой для крови. Слой для крови располагается между двумя кислородными слоями, что повышает эффективность оксигенации (насыщения кислородом) крови при равномерном потоке. При этом разработанная нами матричная имеет масштабируемый многоуровневый дизайн, что позволяет создавать физиологические схемы кровотока в микрофлюидном оксигенаторе. Кровеносная сосудистая сеть представляет собой микрослой, содержащий массив микрокапилляров и имитирует архитектуру микроциркуляции in vivo, которая позволяет равномерно распределять кровь.

— Способен ли такой имплантат полностью заменить естественные лёгкие человека? Как, например, «обойти» проблему образования тромбов?
— Да, конечная цель проекта состоит в создании носимых искусственных лёгких. Но, здесь необходимо обратить внимание на то, что речь пока идёт об экстракорпоральном (находящемся вне тел) подключении данного прибора. Создание искусственных лёгких полностью выполняющих весь дыхательный цикл с их имплантацией в организм пока не входит в задачи настоящего проекта.
Но, действительно, преодоление гемолиза (процесс разрушения эритроцитов) и тромбоза является одной из ключевых задач при разработке таких устройств. Ключевая роль при разрушении эритроцитов принадлежит сдвиговым напряжениям, возникающим в результате воздействия механических сил. Они напрямую зависят от скорости кровотока, характера течения и давления внутри устройства. Критический фактор, способствующий разрушению мембраны эритроцитов, —достижение определённого порогового потенциала. Этот порог, соответствующий сдвиговому напряжению в кровотоке, определён на уровне 100 Паскалей. Превышение данного значения приводит к повреждению мембраны эритроцитов. Для исключения указанного механического фактора были проведены гидродинамические исследования, в рамках которых производились измерения величины свинговых напряжений и их распределение по микрофлюидному оксигенатору. Другим фактором, способным вызвать тромбоз, является материал и используемое покрытие. Мы провели комплекс исследований, в рамках которых нам удалось подобрать максимально биосовместимый материал и пройти комплекс исследований invivo на животных. Следующая наша цель состоит в проведении более длительных исследований.
— А что служит «сырьём» для 3D-биопечати искусственного лёгкого?
— В качестве сырья используется несколько модификаций силиконового компаунда, но состав и технологии его применения мы не раскрываем до момента получения охранного документа на РИД.
— В какой стадии сегодня процесс создания материала и технологии для искусственных лёгких? Когда ждать массового применения этого метода в системе здравоохранения? Насколько такая методика лечения будет доступной?
— Из баз данных Web of Science, Scopus, PubMed, Elsevier известны различные микрофлюидные оксигенат оры. Их отличительной особенностью является строение микрокапилляров. Есть микрофлюидные оксигенаторы с круглыми, прямоугольными, квадратными каналами. Из литературных данных известно также о скорости кровотока (мл/мин) развиваемой данными оксигенаторами, и видах исследований. Наибольшая скорость кровотока одного мембранного модуля составляет 30 мл/мин. Скорость кровотока, разработанного нами оксигенатора, составляет 60 мл/мин.
Исходя из данных, полученных в доступной научной литературе, наиболее эффективными микрофлюидными оксигенаторами сегодня являются: многослойный биомиметический микрофлюидный оксигенатор. Его разрабатывает научная группа: Draper, Кембридж, Массачусетс, США. Исследовательская программа автономной реанимации и эвакуации (AREVA), Женевский фонд, Сан-Антонио, Техас, США. Thrombodyne, Inc., Солт-Лейк-Сити, Юта, США. Микрожидкостный оксигенатор крови с двухсторонними микроканалами разрабатывает Университет McMaster, Гамильтон, Онтарио L8S 4L7, Канада.

Перечисленные микрофлюидные оксигенаторы находятся на стадии разработки invitro и invivo.
Мы полагаем, что данный вид аппаратов будет очень распространён, так как, во-первых, методика экстракорпоральной мембранной оксигенации (ЭКМО) эффективно применяется уже несколько десятилетий и очень востребована в клиниках, во-вторых, на рынке сегодня представлены различные варианты биосовместимого материала, подходящего для таких приборов, что существенно ускоряет сроки освоения технологий. И наконе, в-третьих, микрофлюидные оксигенаторы постоянно модифицируются. Например, наше устройство: содержат сети кровотока, в которых эритроциты и тромбоциты испытывают давление, напряжения сдвига и углы разветвления, сопоставимые такими же в лёгких человека. Обеспечивает повышенную газообменную способность, и потенциально способно обеспечивать респираторную поддержку активным пациентам. Потенциально наш аппарат способен работать с комнатным воздухом, устраняя необходимость в газовых баллонах, и позволяет избежать гипероксемию (повышенное содержание кислорода в крови) – в этой части ведутся исследования.
На наш взгляд такие приборы могут стать массово доступными примерно лет через 5–7.
Один из вопросов, над которым мы работаем сегодня, — как лабораторные технологии, — перенести на производственные линии. Полагаем, что подобными вопросом задаются все научные центры, занимающиеся данными разработками.
— Куда движется современная биоинженерия? Чего ждать от учёных в ближайшее время?
— Современная биоинженерия в том числе направлена и на создание искусственных органов. В мировом научном сообществе, в течение последних десяти лет, микрофлюидные оксигенаторы стали рассматриваться в качестве потенциального средства повышения эффективности и безопасности оксигенаторов применяемых в составе ЭКМО, а также как путь к созданию искусственных лёгких. Отчёт AdroitMarketResearch о мировом рынке носимых искусственных органов даёт целостное представление о рынке с 2018 по 2028 год, которое включает такие факторы, как движущие силы рынка, ограничения, возможности и проблемы. Прогнозируется, что к 2028 году мировой рынок носимых искусственных органов достигнет 17,87 млрд долларов США, увеличившись в среднем на 15,9%.
Растущая распространённость недостаточности органов, технические преимущества искусственных органов и растущий спрос, и дефицит предложения донорских органов стимулируют рост мирового рынка носимых искусственных органов.
— Спасибо, Катерина Олеговна, за такую интересную информацию. Успехов вашей команде в реализации этого проекта!
Беседовала Марина Неупокоева
Фотографии предоставлены героем публикации
Читайте также